本文来自微信公众号:科工力量(ID:guanchacaijing),作者:清柠,题图来自:视觉中国
8月26日,陈阿姨从上海瑞金医院出院了。
她进医院的原因,是弥漫大B细胞淋巴瘤。作为成年人身上最常见的淋巴系统肿瘤,这类肿瘤很容易复发,后续治疗效果也不显著。如果患者像陈阿姨一样属于高龄群体,一些手术和化疗也无法进行。
不过这一次,她的治疗相当成功:在8月底的PET-CT检查中,陈阿姨体内肿瘤细胞已经消退,住院不到两个月,她就可以回家了。
陈阿姨关注的,是自己的病情。媒体关注的,却是药物的费用:一份泄露的药品收款凭证显示,她使用的药物,购药款达到了120万元人民币。高昂的价格,神奇的疗效,也让“120万一针抗癌药”的标题,在社交平台中甚嚣尘上。
讽刺的是,被这场舆论狂欢捧上风口的“嵌合抗原受体T细胞免疫疗法”(CAR-T),似乎并没有那么神奇。
01 高效便捷的疗法
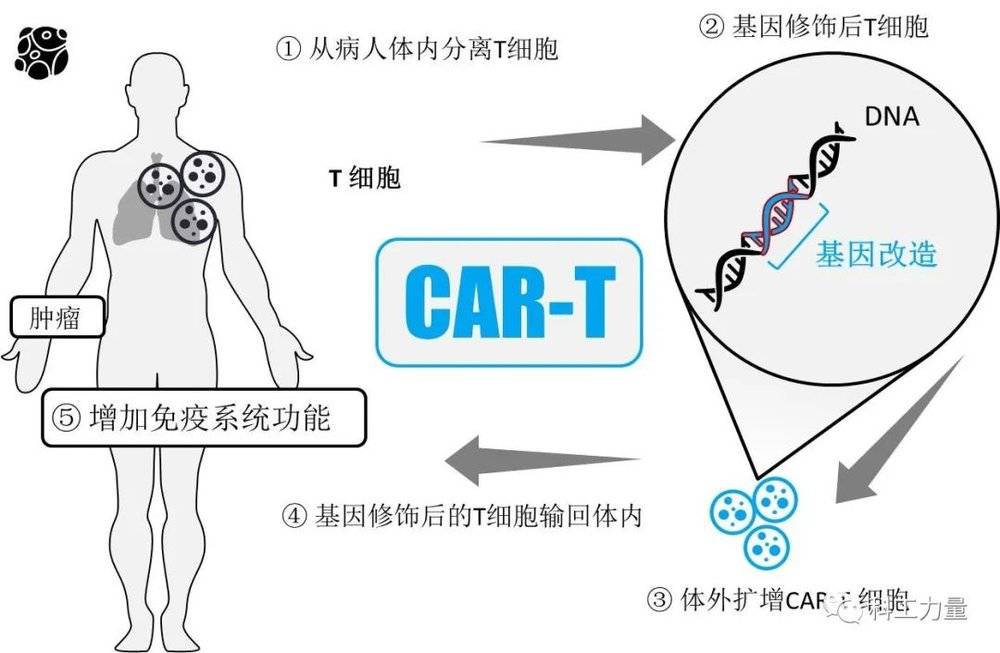
比起中文学名,CAR-T的英文缩写,对药物原理展示的更简洁。想要理清CAR-T的原理,也不妨从这个名字入手。
CAR-T中的T,指的就是T细胞。这种细胞源自骨髓,在胸腺中分化,并通过淋巴和血液循环发挥免疫功能。T细胞的细分种类有很多,整体而言,就是调动体内免疫反应,杀死体内有问题的细胞,是免疫战线的“指挥官”。
CAR-T疗法中的主要步骤,就要从患者血液中分离T细胞,进行改造和培养。这有点像从战乱小国中挑选优秀军官,送到大国军事院校进修。让军官拉起一帮自己的队伍,使用更强的武器回国平叛。T细胞要做的,实际上也差不多。
CAR-T中的CAR,相对复杂一点。它的全称是嵌合抗原受体(CAR),能和肿瘤细胞表面特定蛋白质或抗原结合。这些受体并非自然存在,而是人工筛选合成,相当于T细胞“军官”进修学习的“军事技能”和“武器”。有了这些受体,提取的T细胞才能发挥作用。
有了T细胞,加上受体。还要把改造的CAR-T细胞送回患者体内。它们会自行增殖,通过特殊受体结合对应肿瘤细胞,让免疫系统消灭肿瘤。由于针对性强,又是自身免疫。理想情况下,CAR-T疗法最终结果就是让“体内肿瘤消失”。
如果不论技术复杂性,仅从实际结果评价。CAR-T疗法的流程相当简洁:提取T细胞和输回CAR-T细胞只要几个小时,培养细胞只需几周。同操作更为复杂的化疗和手术相比,CAR-T确实算是“省力省心”。
不过CAR-T疗法的故事,到这里还没完。
02 效果有限的神药
国内针对CAR-T疗法的宣传中,离不开一个外国人:Emily Whitehead。
她在2012年因急性淋巴细胞白血病(ALL)两次复发,选择参与诺华CTL019的I期临床试验(而诺华也一直以高价特殊药物引人关注——笔者注)。她在接受治疗后,由于CAR-T细胞反应过度,引发了细胞因子释放综合征(CRS)。
简单来说,免疫细胞产生巨量细胞因子,导致免疫细胞杀死肿瘤细胞后敌我不分。不过Emily是幸运的,医疗团队通过免疫抑制药物,控制住了免疫反应。她在体内肿瘤细胞消失后,每年都会拍一张“肿瘤未复发”的纪念照。这张照片也已经连续拍摄了九年。
(图为Emily Whitehead)
不过我们把Emily和陈阿姨的故事连起来,就会发现一个问题:CAR-T疗法针对的,都是淋巴瘤或者白血病,其他领域却少有报道。这款“癌症神药”,好像也是“捡软柿子捏”。
CAR-T细胞目前适用范围有限,与它针对的目标有关。该疗法最早针对的抗原,是癌变B细胞表面的CD19。就算后来增加新抗原CD22,依旧绕不开癌变B细胞。
抗原少,识别目标范围就小,针对的肿瘤种类也会大幅降低。如果肿瘤细胞变异出新抗原,还会逃过CAR-T细胞的识别,导致肿瘤复发。
CAR-T让肿瘤消失,却不等于治愈。
美国宾夕法尼亚大学此前针对急性淋巴细胞白血病的CAR-T治疗研究也指出:30名患者中,患者治疗后寿命达到6个月的占比为78%,并非100%。CAR-T显著缓解了肿瘤发展,然而抗癌之路并没有走完。
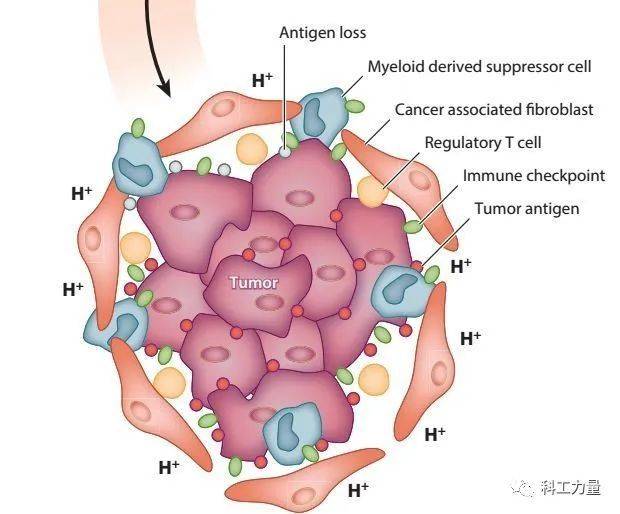
CAR-T疗法当中,经常提到的另一个词是“实体瘤”。非实体瘤,往往是松散的肿瘤细胞在体内漂流,更像游击队。实体瘤则是肿瘤细胞聚在一起,在身体各处安营扎寨,化身正规军。二者的清除难度,显然不是一个量级。
(实体瘤复杂的细胞构成)
识别抗原,定点清除的CAR-T细胞,更像是特种部队:打游击队相对容易,单枪匹马对付大批正规军,心有余而力不足。与抗原统一的非实体瘤相比,实体瘤可能有多种肿瘤细胞,每个细胞的抗原不统一。这样的条件,CAR-T疗法也难以大显身手。
患者是淋巴瘤和白血病,CAR-T会很有效。如果是神经母细胞瘤或者肝细胞瘤这种实体瘤,CAR-T的治疗就会很艰难。
除了上述限制,CAR-T依赖免疫细胞,也让它成为了一把双刃剑。免疫细胞迅速起效,往往会产生“细胞因子风暴”,引发过度免疫,甚至影响脑部功能。如果使用托珠单抗、糖皮质激素等免疫抑制药物,CAR-T的疗效又会打折扣。如何平衡治疗代价又变成了难题。
这个世界不存在药神,也不存在神药,CAR-T能做的也很有限。
03 似曾相识的狂欢
CAR-T的疗效说完了,120万元的“天价”,似乎又成了新问题。
考虑到CAR-T疗法的流程,这个问题并不是问题。CAR-T疗法从患者提取T细胞,每个人的T细胞都是独一无二,对应的治疗自然高度个性化。CAR-T后续的细胞培养和储存运输,也要对标活细胞培养规格,带来的就是高昂的治疗成本。
如果把120万的价格,同国外同类产品相比:诺华的Kymriah是47.5万美元;吉利德旗下凯特的Tecartus报价37.3万美元;百时美施贵宝的Abecma价格41.95万美元。单纯比较汇率的话,国内的CAR-T产品似乎太便宜了点。
(图为百时美施贵宝的Abecma,大多数CAR-T产品的包装都是类似的输液袋)
然而医疗领域的消费价格,不能只按照汇率比较。按照国际货币基金组织给出的购买力平价计算,1美元的购买力,约为4.2元人民币。换算之后,上述厂商的CAR-T疗法价格,基本在150万到200万人民币上下。
据行业人士透露,国内CAR-T疗法市场成熟价格预期,基本在50到80万人民币左右。目前该疗法价格高昂,主要还是填补前期的研发成本。
以复星凯特为例,针对旗下CAR-T产品阿基仑赛,公司已累计投入研发资金人民币6.7亿元。其竞争对手药明巨诺,2019、2020两年累计研发开支也已超过3.5亿元。
但是国内狭小的淋巴瘤市场,也承担不起这款高价的神药。目前获批的CAR-T药品中,复星凯特的阿基伦赛和药明巨诺的瑞吉伦赛,治疗的都是复发难治性大B细胞淋巴瘤。以中国流行病学为基准,淋巴瘤整体发病率为万分之一,患者规模不高于15万人。
按照大B细胞淋巴瘤接近三分之一的患者占比计算,适应症群体规模约为5万人。考虑到我国淋巴瘤患者群体偏小,这一数据还可以缩小到3~4万人。要求这3万人都能掏出120万,去买单一个不能治愈的疗法,实在过于苛刻。
尽管如此,国内医疗市场依旧对CAR-T疗法充满信心。今年6月22日,中国国家药品监督管理局发出公示,复星凯特的阿基仑赛注射液正式批准上市。不到90天,药明巨诺同类药物瑞吉伦赛也获批上市。一年之内两款药物上市,让2021年变成了“CAR-T元年”。
国内企业能够如此“胆大”,离不开资本的撑腰。据毕马威相关统计,去年国内开展CAR-T疗法的临床试验数量达到335个,其中CD19靶点药物超40%。
不光产品同质化,像是复星凯特和药明巨诺这样的企业,也都走上了“跟国外巨头合资,再引进药物研发”的发展模式,让公司经营也进入了同质化。
如此激进的行业豪赌,很难不让人想到医药行业的PD-1类药物。自2014年PD-1药物“欧狄沃”(O药)和“可瑞达”(K药)上市以来,强劲营收就让企业魂牵梦绕。仅在今年上半年,默沙东“可瑞达”销售额就达80.8亿美元,每个小时有快185万美元进账。
亮眼的数据,加上生物行业人才回流。让中国医药从2018年开始,陷入了“PD-1狂热”:恒瑞、豪森、君实、信达、百济神州……如果一家企业没有“单抗”结尾的PD-1产品,它就没有行业的“创新”思维。
遗憾的是,热度过后,PD-1市场剩下的只有一片红海。
2021年上半年,百济神州营收48.89亿元,净亏损26.77亿元;信达生物营收19.42亿元,同比增长97.3%,净亏损11.75亿元;传统药企巨头恒瑞,也因PD-1产品导致收入负增长。以至于隐退一年的孙飘扬也不得不付出,重新担任恒瑞董事长。
CAR-T市场的狂热,很难不让人想到当初的PD-1。CAR-T需要回答的,也是同样的问题:潮水之后,谁来买单?
本文来自微信公众号:科工力量(ID:guanchacaijing),作者:清柠
原创文章,作者:3628473679,如若转载,请注明出处:https://blog.ytso.com/industrynews/161146.html